Koolstof: verschil tussen versies
(Aanzet Koolstof) |
|||
| Regel 37: | Regel 37: | ||
<gallery> | <gallery> | ||
Bestand:Carbon-dioxide-3D-vdW.svg|Koolstofdioxine [[molecuul]] (CO<sub>2</sub>) met 1 koolstof [[atoom]] (C) en 2 zuurstof atomen (O). Ook bekend als koolzuurgas of prik in limonade | Bestand:Carbon-dioxide-3D-vdW.svg|Koolstofdioxine [[molecuul]] (CO<sub>2</sub>) met 1 koolstof [[atoom]] (C) en 2 zuurstof atomen (O). Ook bekend als koolzuurgas of prik in limonade | ||
| − | Bestand:Carbonic-acid-3D-balls.png|Koolzuur (H<sub>2</sub>CO<sub>3</sub>), | + | Bestand:Carbonic-acid-3D-balls.png|Koolzuur (H<sub>2</sub>CO<sub>3</sub>), of (di)waterstofcarbonaat. Wordt gebruikt in bruistabletten voor het oplossen van geneesmiddelen, vitamines, etc. |
Bestand:Carbon monoxide 3d model 2.png|Koolmonoxide (CO) | Bestand:Carbon monoxide 3d model 2.png|Koolmonoxide (CO) | ||
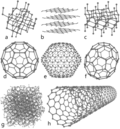
Bestand:Eight Allotropes of Carbon.png|Acht voorbeelden van allotropen van koolstof: a) Diamant, b) Grafiet, c) Lonsdaleiet, d) C60 (Buckminsterfullereen), e) C540 (Fullereen), f) C70 (Fullereen), g) Amorfe koolstof (b.v. houtskool), h) enkelwandige koolstof nanobuis | Bestand:Eight Allotropes of Carbon.png|Acht voorbeelden van allotropen van koolstof: a) Diamant, b) Grafiet, c) Lonsdaleiet, d) C60 (Buckminsterfullereen), e) C540 (Fullereen), f) C70 (Fullereen), g) Amorfe koolstof (b.v. houtskool), h) enkelwandige koolstof nanobuis | ||
Versie van 5 sep 2021 16:53
| Chemisch element | |

| |
| Een stukje antraciet | |
| Naam | Koolstof / Carbonium (Latijn) |
| Symbool | C |
| Atoomnummer | 6 |
| Soort | niet-metaal |
| Kleur | zwart |
| Smeltpunt | 3652 oC |
| Kookpunt | 4827 oC |
| Portaal | |
|---|---|
|
|
Koolstof (van het Latijn : carbo "kool") is een scheikundig element met het symbool C en atoomnummer 6. Het is niet-metaalachtig. Het behoort tot groep 14 van het periodiek systeem. Koolstof in zijn natuurlijke vorm, vormt slechts ongeveer 0,025 procent van de aardkorst. Koolstof is een van de weinige elementen die sinds de oudheid bekend zijn. In de natuur kan koolstof onder anderen voorkomen in de vorm van diamant, grafiet en normale koolstof. Koolstof is wat overblijft nadat je hout verbrandt.
Koolstof is het 15e meest voorkomende element in de aardkorst, en het vierde meest voorkomende element in het universum in massa na waterstof, helium en zuurstof. De overvloed aan koolstof, met een enorme variatie aan organische verbindingen (koolwaterstoffen) en het ongebruikelijke vermogen om polymeren (is een stof of een materiaal dat bestaat uit zeer grote moleculen of macromoleculen) te vormen bij de temperaturen die gewoonlijk op aarde worden aangetroffen. De polymeren stellen dit element in staat om te dienen als een gemeenschappelijk element van al het bekende leven. Het is het tweede meest voorkomende element in het menselijk lichaam in massa (ongeveer 18,5%) na zuurstof.
De atomen van koolstof kunnen op verschillende manieren aan elkaar binden, de zogeheten allotropen. Bekende allotropen zijn grafiet (zit in potlood), diamant, steenkool en fullerenen (ingewikkelde kippengaasachtige atoomstructuren). Het voorkomen van koolstof kan sterk van vorm, kleur en hardheid variëren. Grafiet is bijvoorbeeld ondoorzichtig en zwart, terwijl diamant zeer transparant is. Grafiet is zacht genoeg om een streep op papier te vormen (vandaar de naam, van het Griekse werkwoord "γράφειν", gráfein wat "schrijven" betekent), terwijl diamant het moeilijkste natuurlijk voorkomende materiaal is dat bekend is. Grafiet is een goede elektrische geleider terwijl diamant stroom slecht door laat. Onder normale omstandigheden hebben diamant, koolstofnanobuisjes en grafeen de hoogste warmte geleiding van alle bekende materialen. Alle koolstof-allotropen zijn onder normale omstandigheden vaste stoffen. Koolstof-allotropen zijn chemisch bestand tegen chemische inwerking en vereisen een hoge temperatuur om zelfs met zuurstof te reageren.
Een verbinding tussen koolstof en zuurstof komt in twee gasvormen voor: Koolmonoxide (giftig en verstikkend) en kooldioxide (in de adem die je uitademt). Niet-organische koolstof bronnen zijn kalksteen, dolomieten en koolstofdioxide, maar aanzienlijke hoeveelheden komen voor in organische afzettingen van steenkool, turf en olie. Koolstof vormt een groot aantal verbindingen, meer dan enig ander chemisch element, met bijna tien miljoen verbindingen die tot nu toe zijn beschreven. Een toch is dat aantal maar een heel klein deel van het aantal mogelijke verbindingen wat theoretisch onder standaardomstandigheden te maken zou zijn of zou voorkomen. Om deze reden wordt koolstof vaak de "koning van de elementen" genoemd.
Koolstof als erts of mineraal en organische afzetting
Modellen van koolstof en koolstofverbindingen
Gebruik
Koolstof komt op heel veel plekken voor, zoals in pindakaas en in planten maar ook in bijvoorbeeld diamant. Diamant ontstaat als je koolstof heel erg samendrukt. Koolstof zit ook veel in benzine.
Biologie
Toepassingen
Plaats in het Periodiek systeem
| Periodiek systeem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||