Elektrolyse: verschil tussen versies
k (→Links) |
(clean up, typos fixed: ampere → ampère) |
||
| Regel 1: | Regel 1: | ||
| − | In de scheikunde en productie is '''elektrolyse''' een techniek die gebruik maakt van elektrische gelijkstroom om een anders niet-spontane chemische reactie op gang te brengen en te houden. Elektrolyse is voor chemische bedrijven belangrijk als een stap in de scheiding van [[Chemisch element|chemische elementen]] uit natuurlijk voorkomende bronnen zoals [[ |
+ | In de scheikunde en productie is '''elektrolyse''' een techniek die gebruik maakt van elektrische gelijkstroom om een anders niet-spontane chemische reactie op gang te brengen en te houden. Elektrolyse is voor chemische bedrijven belangrijk als een stap in de scheiding van [[Chemisch element|chemische elementen]] uit natuurlijk voorkomende bronnen zoals [[erts]]en met behulp van een elektrolytische cel. De elektrische spanning die nodig is om elektrolyse te laten plaatsvinden, wordt de ''ontledingspotentiaal'' genoemd. Het woord "lyse" betekent scheiden of breken, dus elektrolyse betekent: "afbraak via elektriciteit". |
Met '''elektrolyse''' haal je bijvoorbeeld [[Zuurstof (element)|zuurstof]] en [[Waterstof (element)|waterstof]] uit water (zie hieronder). |
Met '''elektrolyse''' haal je bijvoorbeeld [[Zuurstof (element)|zuurstof]] en [[Waterstof (element)|waterstof]] uit water (zie hieronder). |
||
| Regel 19: | Regel 19: | ||
Tijdens de latere jaren van Humphry Davy's onderzoek werd Michael Faraday zijn assistent. Tijdens het bestuderen van het proces van elektrolyse onder Humphry Davy, ontdekte Michael Faraday twee wetten van elektrolyse. |
Tijdens de latere jaren van Humphry Davy's onderzoek werd Michael Faraday zijn assistent. Tijdens het bestuderen van het proces van elektrolyse onder Humphry Davy, ontdekte Michael Faraday twee wetten van elektrolyse. |
||
| − | In november 1875 ontdekte [[Paul Émile Lecoq de Boisbaudran]] het chemische element [[gallium]] met behulp van elektrolyse van ''galliumhydroxide'', waarbij 3,4 |
+ | In november 1875 ontdekte [[Paul Émile Lecoq de Boisbaudran]] het chemische element [[gallium]] met behulp van elektrolyse van ''galliumhydroxide'', waarbij 3,4 mg gallium werd ''geproduceerd'' (gemaakt). In december presenteerde hij zijn ontdekking van gallium aan de Academie des Science in Parijs. |
Op 26 juni 1886 voelde [[Ferdinand Frederick Henri Moissan]] zich eindelijk op zijn gemak bij het uitvoeren van elektrolyse op watervrij ''waterstoffluoride'' om een gasvormig zuiver [[Fluor (element)|fluor]]-element te creëren. Voordat hij ''waterstoffluoride'' gebruikte, gebruikte Henri Moissan fluoridezouten met elektrolyse. Zo voerde hij op 28 juni 1886 zijn experiment uit voor de Academie des Science om zijn ontdekking van het nieuwe element fluor te tonen. Bij de kosten van het proberen om elementair fluor te vinden door middel van elektrolyse van fluoridezouten, verloren veel chemici het leven, waaronder Paulin Louyet en Jérôme Nicklès. Dit kwam omdat de vrijkomende gassen giftig of explosief konden zijn. |
Op 26 juni 1886 voelde [[Ferdinand Frederick Henri Moissan]] zich eindelijk op zijn gemak bij het uitvoeren van elektrolyse op watervrij ''waterstoffluoride'' om een gasvormig zuiver [[Fluor (element)|fluor]]-element te creëren. Voordat hij ''waterstoffluoride'' gebruikte, gebruikte Henri Moissan fluoridezouten met elektrolyse. Zo voerde hij op 28 juni 1886 zijn experiment uit voor de Academie des Science om zijn ontdekking van het nieuwe element fluor te tonen. Bij de kosten van het proberen om elementair fluor te vinden door middel van elektrolyse van fluoridezouten, verloren veel chemici het leven, waaronder Paulin Louyet en Jérôme Nicklès. Dit kwam omdat de vrijkomende gassen giftig of explosief konden zijn. |
||
| Regel 27: | Regel 27: | ||
== Hoe het werkt == |
== Hoe het werkt == |
||
| − | Het te scheiden vloeibare materiaal of vaste materiaal dat wordt opgelost of gesmolten. Hierdoor kunnen de [[ |
+ | Het te scheiden vloeibare materiaal of vaste materiaal dat wordt opgelost of gesmolten. Hierdoor kunnen de [[ion]]en (deeltjes die horen bij een [[molecuul]]) vrij in de vloeistof bewegen. |
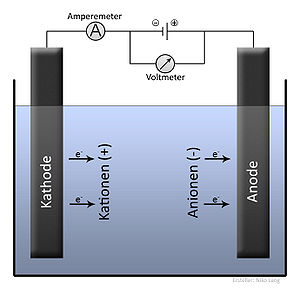
In de vloeistof worden twee staafjes gedompeld: de elektroden waarvan één de ''kathode'' (verbonden aan de min van de stroombron) en de andere de ''anode'' (verbonden aan de plus van de stroombron). Tussen deze elektroden wordt een elektrische gelijkspanning aangebracht zoals die uit een [[Batterij (elektrisch)|batterij]] of een gelijkstroom [[transformator]] komt. Hierdoor zullen positief geladen deeltjes (kationen) naar de kathode bewegen ('zwemmen') en negatief geladen deeltjes (anionen) naar de anode. Aan de kathode vindt een zogeheten ''reductie-reactie'' (afbreek reactie) plaats. Hierbij staat de kathode elektronen af aan stoffen in de oplossing (de vloeistof). Aan de anode vindt een oxidatie-reactie (opbouw reactie) plaats, waarbij de elektrode elektronen opneemt van stoffen in de oplossing. De energie die nodig is voor het scheiden, is afhankelijk van de concentratie van de oplossing en neemt toe naarmate de concentratie hoger wordt. |
In de vloeistof worden twee staafjes gedompeld: de elektroden waarvan één de ''kathode'' (verbonden aan de min van de stroombron) en de andere de ''anode'' (verbonden aan de plus van de stroombron). Tussen deze elektroden wordt een elektrische gelijkspanning aangebracht zoals die uit een [[Batterij (elektrisch)|batterij]] of een gelijkstroom [[transformator]] komt. Hierdoor zullen positief geladen deeltjes (kationen) naar de kathode bewegen ('zwemmen') en negatief geladen deeltjes (anionen) naar de anode. Aan de kathode vindt een zogeheten ''reductie-reactie'' (afbreek reactie) plaats. Hierbij staat de kathode elektronen af aan stoffen in de oplossing (de vloeistof). Aan de anode vindt een oxidatie-reactie (opbouw reactie) plaats, waarbij de elektrode elektronen opneemt van stoffen in de oplossing. De energie die nodig is voor het scheiden, is afhankelijk van de concentratie van de oplossing en neemt toe naarmate de concentratie hoger wordt. |
||
| − | Met de |
+ | Met de ampèremeter kun je zien hoeveel stroom er door de vloeistof loopt en met de voltmeter kun je zien hoeveel spanning de stroombron levert. |
| − | In het [[ |
+ | In het [[voortgezet onderwijs]] worden proeven onder begeleiding gedaan. Zoals je hierboven hebt kunnen lezen kan elektrolyse best gevaarlijk zijn. |
== Galvaniseren == |
== Galvaniseren == |
||
Versie van 29 dec 2021 18:41
In de scheikunde en productie is elektrolyse een techniek die gebruik maakt van elektrische gelijkstroom om een anders niet-spontane chemische reactie op gang te brengen en te houden. Elektrolyse is voor chemische bedrijven belangrijk als een stap in de scheiding van chemische elementen uit natuurlijk voorkomende bronnen zoals ertsen met behulp van een elektrolytische cel. De elektrische spanning die nodig is om elektrolyse te laten plaatsvinden, wordt de ontledingspotentiaal genoemd. Het woord "lyse" betekent scheiden of breken, dus elektrolyse betekent: "afbraak via elektriciteit".
Met elektrolyse haal je bijvoorbeeld zuurstof en waterstof uit water (zie hieronder).
Geschiedenis
Zoals je zult merken is de ontdekking van de elektrolyse een best ingewikkeld verhaal. Vandaar dat scheikunde ook pas in het voortgezet onderwijs wordt verteld, teminste, als je het als vak kiest.
Het woord "elektrolyse" werd bedacht door Michael Faraday in de 19e eeuw, op voorstel van ds. William Whewell, met behulp van de Griekse woorden ἤλεκτρον [ɛ̌ːlektron] "elektron", dat sinds de 17e eeuw werd gekoppeld aan elektrische verschijnselen, en λύσις [lýsis] betekent "ontbinding of scheiding".
In het begin van de negentiende eeuw probeerden William Nicholson en Anthony Carlisle de proeven van Alessandro Volta voort te zetten. Ze bevestigden twee draden aan weerszijden van Volta's batterij en plaatsten de andere uiteinden in een buis gevuld met water. Ze merkten dat wanneer de draden bij elkaar werden gebracht, elke draad gasbellen produceerde (maakte). Het ene type gas bleek waterstof te zijn, en het andere was zuurstof.
In 1785 creëerde een Nederlandse wetenschapper genaamd Martinus Van Marum een elektrostatische generator die hij gebruikte om tin, zink en antimoon uit hun zouten te verminderen met behulp van een proces dat later bekend stond als elektrolyse. Hoewel hij onbewust elektrolyse produceerde, duurde het tot 1800 voordat William Nicholson en Anthony Carlisle ontdekten hoe elektrolyse werkt.
In 1791 deed Luigi Galvani proefjes met kikkerbilletjes. Hij beweerde dat het plaatsen van dierlijke spieren tussen twee ongelijke metalen platen elektriciteit deed ontstaan. In reactie op deze beweringen voerde Alessandro Volta zijn eigen tests uit. Dit zou inzicht geven in Humphry Davy 's ideeën over elektrolyse. Tijdens voorlopige experimenten (proefjes) bedacht Humphry Davy dat wanneer twee chemische elementen samen een verbinding vormen, er elektrische energie vrijkomt. Humphry Davy zou decompositietabellen gaan maken op basis van zijn voorlopige experimenten met elektrolyse. De decompositietabellen zouden inzicht geven in de energieën die nodig zijn om bepaalde verbindingen uit elkaar te halen (vandaar ook de term scheikunde).
In 1817 bepaalde Johan August Arfwedson dat er een ander element, lithium, in sommige van zijn monsters (uit proefje ontstaan materiaal) zat; hij kon het onderdeel echter niet isoleren (apart krijgen). Pas in 1821 gebruikte William Thomas Brande elektrolyse om het te onderscheiden. Twee jaar later stroomlijnde hij het proces met behulp van de stoffen lithiumchloride en kaliumchloride met elektrolyse om lithium en lithiumhydroxide te maken.
Tijdens de latere jaren van Humphry Davy's onderzoek werd Michael Faraday zijn assistent. Tijdens het bestuderen van het proces van elektrolyse onder Humphry Davy, ontdekte Michael Faraday twee wetten van elektrolyse.
In november 1875 ontdekte Paul Émile Lecoq de Boisbaudran het chemische element gallium met behulp van elektrolyse van galliumhydroxide, waarbij 3,4 mg gallium werd geproduceerd (gemaakt). In december presenteerde hij zijn ontdekking van gallium aan de Academie des Science in Parijs.
Op 26 juni 1886 voelde Ferdinand Frederick Henri Moissan zich eindelijk op zijn gemak bij het uitvoeren van elektrolyse op watervrij waterstoffluoride om een gasvormig zuiver fluor-element te creëren. Voordat hij waterstoffluoride gebruikte, gebruikte Henri Moissan fluoridezouten met elektrolyse. Zo voerde hij op 28 juni 1886 zijn experiment uit voor de Academie des Science om zijn ontdekking van het nieuwe element fluor te tonen. Bij de kosten van het proberen om elementair fluor te vinden door middel van elektrolyse van fluoridezouten, verloren veel chemici het leven, waaronder Paulin Louyet en Jérôme Nicklès. Dit kwam omdat de vrijkomende gassen giftig of explosief konden zijn.
In 1886 vroegen Charles Martin Hall uit Amerika en Paul Héroult uit Frankrijk allebei Amerikaanse patenten aan, die Héroult in mei indiende en Hall in juli. Hall was in staat om zijn patent te krijgen door via brieven aan zijn broer en familie het bewijs te leveren dat zijn methode werd ontdekt voordat het Franse patent werd ingediend. Dit werd bekend als het Hall-Héroult- proces, waarvan veel industrieën profiteerden omdat de prijs van aluminium was gedaald van vier dollar naar dertig cent per pond, door dit proces te gebruiken.
Hoe het werkt
Het te scheiden vloeibare materiaal of vaste materiaal dat wordt opgelost of gesmolten. Hierdoor kunnen de ionen (deeltjes die horen bij een molecuul) vrij in de vloeistof bewegen.
In de vloeistof worden twee staafjes gedompeld: de elektroden waarvan één de kathode (verbonden aan de min van de stroombron) en de andere de anode (verbonden aan de plus van de stroombron). Tussen deze elektroden wordt een elektrische gelijkspanning aangebracht zoals die uit een batterij of een gelijkstroom transformator komt. Hierdoor zullen positief geladen deeltjes (kationen) naar de kathode bewegen ('zwemmen') en negatief geladen deeltjes (anionen) naar de anode. Aan de kathode vindt een zogeheten reductie-reactie (afbreek reactie) plaats. Hierbij staat de kathode elektronen af aan stoffen in de oplossing (de vloeistof). Aan de anode vindt een oxidatie-reactie (opbouw reactie) plaats, waarbij de elektrode elektronen opneemt van stoffen in de oplossing. De energie die nodig is voor het scheiden, is afhankelijk van de concentratie van de oplossing en neemt toe naarmate de concentratie hoger wordt.
Met de ampèremeter kun je zien hoeveel stroom er door de vloeistof loopt en met de voltmeter kun je zien hoeveel spanning de stroombron levert.
In het voortgezet onderwijs worden proeven onder begeleiding gedaan. Zoals je hierboven hebt kunnen lezen kan elektrolyse best gevaarlijk zijn.
Galvaniseren
Elektrolyse wordt ook gebruikt om een dun laagje metaal op een voorwerp aan te brengen. Bijvoorbeeld een ijzeren bumper van een auto waarop een laagje glimmend chroom wordt aangebracht. Dit proces heet galvaniseren. Het wordt ook wel coaten genoemd. Soms laten ouders de eerste kinderschoentjes van hun kind vergulden (met goud), verkoperen of verzilveren.
Links
- Eenvoudig proefje met keukenzout: Ontdek chemie
- Verchromen: Filmpje Klokhuis